Come funziona una batteria piombo-acido
Come è noto, nell’utilizzare anche in modo ottimale gli accumulatori piombo-acido, si ha sempre un deterioramento del sistema chimico-meccanico. Parte di questo deterioramento risulta irrecuperabile, una parte invece, con opportune operazioni e macchinari, è possibile recuperarlo.
Il deterioramento irrecuperabile, è dato dalla perdita della materia attiva che compone le piastre degli elementi: questo fenomeno avviene sia per l’eccessivo innalzamento della temperatura, a cui le piastre sono sottoposte durante la ricarica e la scarica, sia all’eccesiva concentrazione di acido solforico, derivante dalla mancanza di adeguati rabbocchi dell’acqua distillata. Un altro fenomeno che riduce notevolmente la vita di una batteria, è la metallizzazione dei separatori, che per effetto di questo fenomeno, iniziano a opporre una resistenza sempre più alta al passaggio della corrente. Per la prima legge di Ohm, al crescere della resistenza, si ha un ulteriore innalzamento della temperatura, ma si ha anche un deleterio e anomalo innalzamento della tensione, con il risultato che la ricarica della batteria, ha una durata sempre più breve con un’inevitabile calo della capacità. Il deterioramento che risulta essere recuperabile invece, è il fenomeno della SOLFATAZIONE. Gli elementi delle batterie al piombo, sono composti da piastre positive e negative immerse in una soluzione di acido solforico H2SO4(elettrolito). Le piastre positive sono costituite da biossido di piombo (PbO2), mentre le piastre negative da piombo puro spugnoso (Pb). Per produrre energia, durante la fase di scarica, all’interno della batteria si produce una reazione chimica, nella quale l’elettrolito si combina con la materia attiva delle piastre positive e negative, trasformandola in solfato di piombo (PbSO4). Questo composto chimico di risulta, è il sale di piombo dell’acido solforico, e si presenta sotto forma di cristalli bianchi o di polvere bianca, molto poco solubile in acqua: esso si deposita sulle piastre degli elementi delle batterie durante la fase di scarica. Quando tutto l’elettrolito a reagito chimicamente con le piastre degli elementi, la densità risulta essere quasi quella dell’acqua, e non essendovi più possibilità di reazione chimica, si definisce la batteria scarica: è quindi necessario ricaricare la batteria di energia.
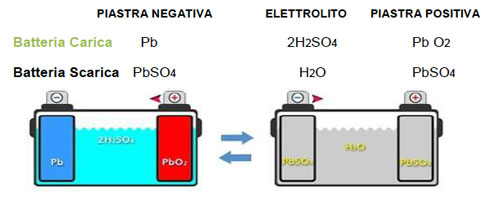 Durante la fase di ricarica , l’energia elettrica fornita, riporta le materie attive (positive e negative) alle loro condizioni originali: il solfato di piombo si ritrasforma in piombo metallico e acido solforico al polo negativo e in biossido di piombo e acido solforico al polo positivo.
Durante la fase di ricarica , l’energia elettrica fornita, riporta le materie attive (positive e negative) alle loro condizioni originali: il solfato di piombo si ritrasforma in piombo metallico e acido solforico al polo negativo e in biossido di piombo e acido solforico al polo positivo.
Nella realtà dei fatti però, accade che parte del solfato di piombo, durante ogni ricarica, non riesce a ritornare alla fase iniziale, e si va ad accumulare pian piano sulle piastre degli elementi, formando una strato compatto e spesso di materia inattiva. Solitamente questo fenomeno si concentra sulla parte alta delle piastre, e riduce notevolmente la superfice utile a disposizione per la reazione chimica. La riduzione di acido solforico a disposizione per la reazione chimica, la riduzione della superfice utile alla reazione, e la resistenza elettrica che oppone questo strato di solfato di piombo, riducono notevolmente la capacità e la vita delle batterie.